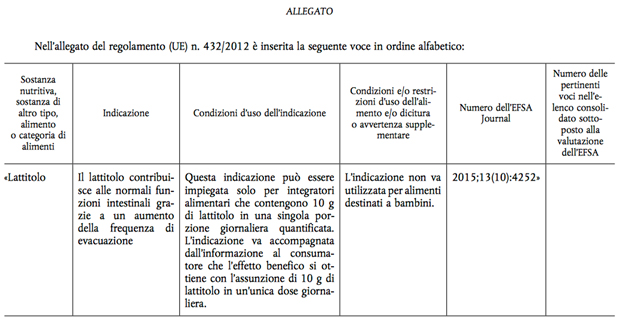
Grazie al Regolamento di Esecuzione (UE) 2017/676 (di seguito riportato integralmente) è stato autorizzato il claim “il Lattitolo contribuisce alle normali funzioni intestinali grazie a un aumento della frequenza di evacuazione”.
Questa indicazione può essere utilizzata solo per integratori alimentari che contengono 10g di Lattitolo in una singola porzione giornaliera quantificata. L’indicazione va accompagnata dall’informazione al consumatore che l’effetto benefico si ottiene con l’assunzione di 10g di lattitolo in un’unica dose giornaliera. Ovviamente questa indicazione non va utilizzata per alimenti destinati ai bambini.

Il lattitolo (E966) è un glucide (precisamente un disaccaride), prodotto artificialmente, che viene utilizzato come dolcificante negli alimenti light (ipocalorici) al posto dello zucchero grazie al suo alto potere edulcorante.
A moderate concentrazioni funge da prebiotico mentre ad alti dosaggi serve da lassativo.

REGOLAMENTO DI ESECUZIONE (UE) 2017/676
della Commissione del 10 aprile 2017
che autorizza un’indicazione sulla salute fornita sui prodotti alimentari, diversa da quelle facenti riferimento alla riduzione dei rischi di malattia e allo sviluppo e alla salute dei bambini, e che modifica il regolamento (UE) n. 432/2012
LA COMMISSIONE EUROPEA
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (CE) n. 1924/2006 del Parlamento europeo e del Consiglio, del 20 dicembre 2006, relativo alle indicazioni nutrizionali e sulla salute fornite sui prodotti alimentari (1), in particolare l’articolo 18, paragrafo 4,
considerando quanto segue:
(1) Il regolamento (CE) n. 1924/2006 vieta le indicazioni sulla salute fornite sui prodotti alimentari, a meno che non siano autorizzate dalla Commissione a norma del medesimo regolamento e incluse in un elenco di indicazioni consentite.
(2) In applicazione dell’articolo 13, paragrafo 3, del regolamento (CE) n. 1924/2006 è stato adottato il regolamento (UE) n. 432/2012 della Commissione, relativo alla compilazione di un elenco di indicazioni sulla salute consentite sui prodotti alimentari, diverse da quelle facenti riferimento alla riduzione dei rischi di malattia e allo sviluppo e alla salute dei bambini.
(3) Il regolamento (CE) n. 1924/2006 stabilisce inoltre che le domande di autorizzazione delle indicazioni sulla salute possono essere presentate dagli operatori del settore alimentare all’autorità nazionale competente di uno Stato membro. L’autorità nazionale competente è tenuta a trasmettere le domande valide all’Autorità europea per la sicurezza alimentare (EFSA) (di seguito «l’Autorità») per una valutazione scientifica nonché alla Commissione e agli Stati membri per informazione.
(4) Spetta alla Commissione prendere una decisione in merito all’autorizzazione delle indicazioni sulla salute, tenendo conto del parere espresso dall’Autorità.
(5) Al fine di favorire l’innovazione, le indicazioni sulla salute basate su prove scientifiche recenti e/o che includono una richiesta di protezione di dati riservati sono oggetto di una procedura di autorizzazione accelerata.
(6) In seguito a una domanda presentata dalla società DuPont Nutrition BioSciences ApS a norma dell’articolo 13, paragrafo 5, del regolamento (CE) n. 1924/2006, è stato richiesto all’Autorità di esprimere un parere in merito a un’indicazione sulla salute riguardante il lattitolo e il mantenimento della normale funzione di defecazione (domanda n. EFSA-Q-2015-00375). L’indicazione proposta dal richiedente era formulata nel modo seguente: «il lattitolo contribuisce alle normali funzioni intestinali».
(7) Nel parere scientifico pervenuto alla Commissione e agli Stati membri il 13 ottobre 2015 l’Autorità ha concluso che i dati forniti consentivano di stabilire un rapporto di causa-effetto tra il consumo di lattitolo e il mantenimento della normale funzione di defecazione e che la popolazione bersaglio è la popolazione adulta in generale. Un’indicazione sulla salute che rispecchi tale conclusione dovrebbe pertanto essere considerata conforme ai requisiti del regolamento (CE) n. 1924/2006 ed essere inclusa nell’elenco delle indicazioni consentite dell’Unione istituito dal regolamento (UE) n. 432/2012.
(8) A norma dell’articolo 13, paragrafo 3, del regolamento (CE) n. 1924/2006, le indicazioni sulla salute consentite devono essere corredate di tutte le condizioni necessarie per il loro impiego, comprese eventuali restrizioni. L’elenco delle indicazioni consentite dovrebbe pertanto includere la formulazione delle indicazioni, le loro condizioni d’impiego specifiche e, se applicabile, le condizioni o restrizioni d’uso e/o una dicitura o avvertenza supplementare, conformemente a quanto disposto dal regolamento (CE) n. 1924/2006 e in linea con i pareri dell’Autorità.
(9) Uno degli obiettivi del regolamento (CE) n. 1924/2006 è garantire che le indicazioni sulla salute risultino veritiere, chiare, affidabili e utili ai consumatori e che a tale riguardo siano prese in considerazione la loro formulazione e la loro presentazione. Di conseguenza, se la formulazione di un’indicazione utilizzata dal richiedente ha per i consumatori lo stesso significato di un’indicazione sulla salute autorizzata, in quanto dimostra l’esistenza dello stesso rapporto tra una categoria di alimenti, un alimento o uno dei suoi costituenti e la salute, essa dovrebbe essere soggetta alle stesse condizioni d’uso di quella indicata nell’allegato del presente regolamento.
(10) Conformemente all’articolo 20 del regolamento (CE) n. 1924/2006, il registro delle indicazioni nutrizionali e sulla salute, contenente tutte le indicazioni sulla salute autorizzate, dovrebbe essere aggiornato in modo da tener conto del presente regolamento.
(11) È pertanto opportuno modificare di conseguenza il regolamento (UE) n. 432/2012. Gli Stati membri sono stati consultati,
(12) Gli Stati membri sono stati consultati
HA ADOTTATO IL PRESENTE REGOLAMENTO
Articolo 1
L’indicazione sulla salute di cui all’allegato del presente regolamento è inserita nell’elenco di indicazioni consentite dell’Unione di cui all’articolo 13, paragrafo 3, del regolamento (CE) n. 1924/2006.
Articolo 2
L’allegato del regolamento (UE) n. 432/2012 è modificato conformemente all’allegato del presente regolamento.
Articolo 3
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 10 aprile 2017
Per la Commissione
Il presidente
Jean-Claude JUNCKER

© Produzione riservata
—————
——-
Dr. Luciano O. Atzori
Biologo – Esperto in Sicurezza degli Alimenti e in Tutela della Salute
Divulgatore Scientifico – Consulente agroalimentare
Co-founder ISQAlimenti.it